GBT 7416-2008 啤酒大麦
目录
术语和定义
- 啤酒大麦 malting barley
- 经过一定程序认定的,适用于制麦和啤酒酿造的二棱大麦及多棱大麦。
- 二棱大麦 2-row barley
- 二棱大麦的麦穗呈扁形,沿穗轴只有对称的两行籽粒。
- 多棱大麦 multi-row barley
- 四棱和六棱大麦统称为多棱大麦。
- 四棱大麦 4-row barley
- 四棱大麦有两对籽粒互为交错,麦穗断面呈四角形。
- 六棱大麦 6-row barley
- 六棱大麦有六行麦粒围绕一根穗轴而生,麦穗断面呈六角形。
- 千粒重 thousand kernels weight
- 1000颗麦粒的绝干质量。
- 三天发芽率 3-day germination rate
- 三天后大麦发芽粒占总麦粒的百分数,主要表示大麦发芽的整齐程度。
- 五天发芽率 5-day germination rate
- 五天后大麦发芽粒占总麦粒的百分数,主要表示可发芽的大麦百分数。
产品分类
按麦穗形态分为:二棱大麦和多棱大麦(指四棱大麦和六棱大麦)。 按播种季节分为:春大麦和冬大麦。
要求
感官要求
理化要求
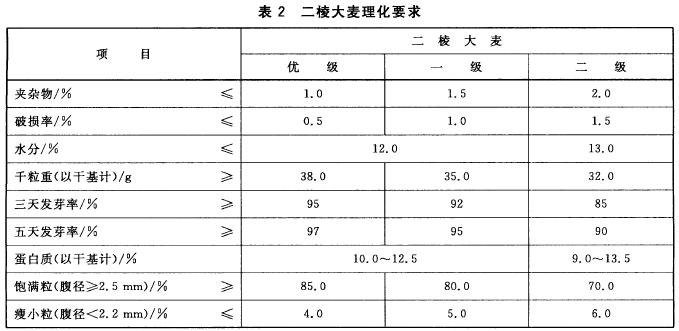
二棱大麦
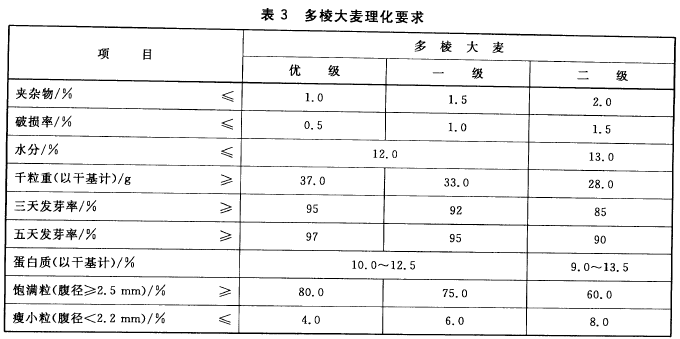
多棱大麦
卫生要求
参照GB 2715-2005 粮食卫生标准和相关标准执行。
分析方法
本方法中所用的水,在没有注明其他要求时,应符合GBT 6682-2008 分析实验室用水规格和试验方法的要求。所用试剂,在未注明其他规格时,均指分析纯(AR)。配制的“溶液”,除另有说明外,均指水溶液。
同一检测项目,有两个或两个以上分析方法时,实验室可根据各自条件选用,但以第一法为仲裁法。
理化分析(除夹杂物、破损率外)所用的大麦样品一律采用除杂均匀的试样。
外观
在自然光线明亮的场所观察大麦的颜色,将大麦样品在受众握5min,并嗅其气味;观看颜色;记录有无光泽、病斑粒(检疫对象所规定的)、霉变粒、霉味或其他异味等情况。
夹杂物
称取样品200g(精确至0.1g),拣出其他植物种子、秸秆、土石等非大麦物质及麸皮、病斑粒(非检疫对象所规定的),在天平(感量0.1g)上称其质量,计算其所占的百分数。
所得结果表示至一位小数。
破损率
称取样品200g(精确至0.1g)拣出破粒、半粒,在天平(感量0.1g)上称其质量,计算其所占的百分数。
所得结果表示至一位小数。
水分
原理
样品于105℃~107℃直接干燥,所失质量的百分数即为该样品的水分。
仪器
- 分析天平:感量0.1mg。
- 电热干燥箱:控温精度±1℃。
- 称量皿:30mm×50mm。
- Miag DLFU盘式粉碎机或旋风磨。
- 干燥器:用变色硅胶做干燥剂。
分析步骤
- 细分试样的制备
- 取一定量大麦试样,使用Miag DLFU盘式粉碎机,盘间距为0.2mm,进行粉碎后,既得到细粉试样。
- 测定
- 称取细粉试样3g~5g(精确至0.0001g),置于已烘至恒重的称量皿中,连同盖一并放入106℃±1℃电热干燥箱内,取下盖子,烘3h。趁热盖上盖子移入干燥器内冷却,30min后称量,然后再放入电热干燥箱内烘1h,称量,直至恒重。
结果计算
试样的水分按下式计算,数值以%表示:
精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的2%。
千粒重
仪器
- 计数器
- 天平:感量0.1g
分析步骤
从检出异物的大麦样品中直接随机数出1000粒大麦颗粒,在天平上称其质量。至少做两次平行试验。
结果计算
试样的千粒重按下式计算,数值以克表示:
- X2 = X2'(1-X1)
- 式中:
- X2——试样的千粒重(以干基计),单位为克(g);
- X2'——直接称量得到的试样风干千粒重,单位为克(g);
- X1——试样水分的质量分数,%
- 所得结果表示至一位小数。
精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的2%。
三天、五天发芽率
培养皿法
仪器
- 培养皿:直径10cm。
- 恒温恒湿培养箱。
- 滤纸:中速滤纸。
分析步骤
将两张直径9cm的中速滤纸放入培养皿底部,加4ml水均匀润湿滤纸。取100粒试样放在滤纸上,使每一麦粒的腹部很好地与滤纸接触,盖上培养皿盖,用薄膜封口以防止水蒸发,或将培养皿放入恒温恒湿培养箱中。在温度18℃~20℃下,于暗处静置发芽。
结果计算
精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的3%。
漏斗法
仪器
- 漏斗:直径100mm,在劲中有一扁平的小玻棒
- 培养皿盖
- 大烧杯
- 喷雾器
分析步骤
取1000粒试样放在大烧杯内,用18℃~20℃水浸渍1h。弃水,用自来水洗5次,再用18℃~20℃水浸渍6h。弃水,转移麦粒到漏斗中,盖上培养皿盖,在18℃~20℃下静置过夜。次日将麦粒倒出,混匀,用喷雾器喷水,使麦粒潮湿,再装回漏斗中。此操作于上午下午各进行一次(两次操作间隔时间为10h~12h)。
结果计算
精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的2%。
蛋白质
原理
在催化剂作用下,用硫酸分解样品,使有机化合物中的氮转变成氨,以硼酸溶液吸收蒸馏出的氨,用酸碱滴定法测定氮含量。
试剂和溶液
- 不含氨的水:按GBT 603-2002 化学试剂 试验方法中所用制剂及制品的制备配置
- 浓硫酸:95%~98%
- 氢氧化钠溶液(400g/L):称取400g氢氧化钠溶于1L不含氨的水中,静置。吸取上层清夜于带橡皮塞的瓶中
- 硼酸溶液(20g/L):称取20g硼酸,用水溶解,并定容至1L
- 盐酸标准滴定溶液[c(HCL) = 0.1mol/L]:按GBT 601-2002 化学试剂 标准滴定溶液的制备配置与标定。
- 混合催化剂:将硫酸钾(K2SO4)、硫酸铜(CuSO4·5H2O)按10+1的比例混合,并研细。
- 溴甲酚绿指示液(1g/L):按GBT 603-2002 化学试剂 试验方法中所用制剂及制品的制备配置
- 甲基红指示液(1g/L):按GBT 603-2002 化学试剂 试验方法中所用制剂及制品的制备配置
- 溴甲酚绿混合指示液:按10+4的比例分别吸取溴甲酚绿乙醇溶液和甲基红乙醇溶液,并混匀。
仪器
- 凯氏定氮仪:自行组装的仪器或成套仪器。
- 天平:感量0.1mg。
- 酸式滴定管:50ml。
分析步骤
成套仪器按使用说明书进行试样测定。自行组装的仪器按下述方法进行操作。
- 细粉试样的制备
- 取一定量大麦试样,使用Miag DLFU盘式粉碎机,盘间距为0.2mm,进行粉碎后,既得到细粉试样。
- 试样消化
- 称取细粉试样1.5g(精确至0.0002g),小心转移到已干燥的凯氏燃烧瓶中,加入混合催化剂10g,缓缓加入浓硫酸20ml,摇匀,在通风橱内文火加热至泡沫停止发生后,大火使之沸腾。待溶液清亮后,再继续加热20~30min。
- 试样蒸馏
- 待消化液冷却后,缓缓加入不含氨的水250ml,摇匀,冷却,并加入几块小瓷片。连接凯氏烧瓶与蒸馏装置,将馏出管的尖端插入已盛有25ml硼酸溶液和0.5ml溴甲酚绿混合指示液的锥形瓶中,馏出管尖端应在液面之下。通过加液漏斗加入70ml氢氧化钠溶液于凯氏烧瓶中,轻轻摇匀,使内容物混匀,然后加热蒸馏。待馏出液达到180ml时,停止蒸馏。
- 试样滴定
- 用盐酸标准滴定溶液滴定馏出液,颜色由绿色消失转变为灰色即为终点。记录消耗盐酸标准滴定溶液的毫升数。
- 按上述操作同时进行空白试验。
结果计算
精密度
在重复性条件下获得的两次独立测定结果的绝对值不得超过算术平均值的4%。
饱满粒、瘦小粒
原理
大麦样品在一个具有不同孔径的三层筛板的振动中,按谷粒大小加以筛分。
仪器
- 天平:感量0.1g。
- 选粒机:由电动机通过曲轴带动,装有3层筛板,上下间距为12mm~25mm,并有盖子和地盘。全机总高度80mm~100mm。
- 选粒机应符合以下要求:
- 筛板材料:由厚度为1.3mm±0.1mm的硬黄铜制成,上有条状孔,加工公差为0.03mm。
- 筛板尺寸:长为43cm,宽为15cm。
- 筛孔尺寸:上面为长度25mm,下面为长度22mm。宽度,筛I为2.8mm,筛II为2.5mm,筛III为2.2mm。
- 筛孔数目:筛I为28×13,筛II为30×13,筛III为32×13.
- 振荡速度:300r/min~320r/min。
- 平台移动的总长度:18mm~22mm。
- 筛面应在两个方向严格保持水平,孔径应经常用双脚规核对。
- 选粒机应符合以下要求:
分析步骤
称取试样100g(精确至0.1g),放入选粒机上层,加盖,开启电动机,准确振荡5min。将2.5mm以上的麦粒进行称量,以百分数表示。
所得结果表示至一位小数。
检验规则
组批
同一产地、同一品种、同一收获期、同等级、同货位、同车船(舱)的产品为一批。
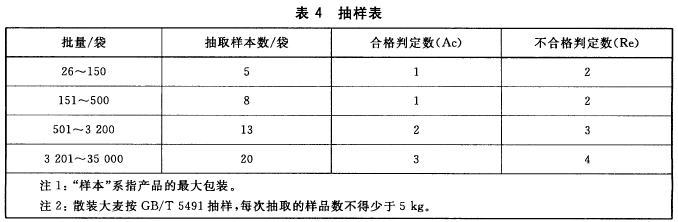
抽样量
按上表抽取样本后,再从每个样本中抽取500g样品,将所有抽取的样品混匀,用对角四分法分为两份,一份封存备查,另一份做感官和理化分析。
交收检验
- 交货时由相应质监部门负责按本标准规定逐批进行检验。
- 交货检验项目包括:净含量、感官要求、夹杂物、破损率、水分、千粒重、三天发芽率、五天发芽率、蛋白质、饱满粒、瘦小粒。
判定规则
- 按抽样表抽取样本,先进性包装盒净含量的检查。若检验结果达到不合格判定数者,则判整批产品为不合格。
- 理化指标中的水分和五天发芽率为质量等级的主要指标,当其他指标都在同一级别时,而水分或五天发芽率指标有一项不在这一级别,则以该指标所在级别为准。
- 理化指标中,所有其他指标都在同一级别,只有一项指标(除水分和五天发芽率外)低于该级别时,不做降级处理。但该项指标低于下一级别时,则降至下一级别。
- 理化指标中,所有其他指标都在同一级别,但有两项指标(除水分和五天发芽率外)低于该级别时,降至下一级别。
标志、包装、运输和贮存
标志
- 啤酒大麦运到粮库或规定地点,应标明产地、产品名称、收获时间、收购日期、类别、等级。
- 销售的产品应具有质量合格证,并标明生产厂名、厂址、产品名称及品种、批号、净重、执行标准代号。
- 储运图示的标志应符合GBT 191-2008 包装储运图示标志的有关规定。
包装
- 无论采用何种包装形式,不同品种、不同产地不得混杂入库。
- 啤酒大麦可以散装,放入筒仓或粮垛。
- 啤酒大麦也可以用麻袋或编织袋包装入库。
运输
啤酒大麦运输时,车厢或其他运输工具应保持清洁、干燥,无外来气味和污染物。
贮存
- 保管大麦要做到先进先出,避免保管不妥,造成损失。
- 仓库要保持清洁、干燥、通风。要定期进行检查,要防潮湿、霉变、鼠虫害等。如发现问题,应及时处理。
- 每批大麦要标明产地、品种、数量、等级、收购日期。
附录A
企业自控技术指标的分析方法
大麦中霉菌数的测定
原理
通过无菌水的冲洗,将大麦表层的微生物冲于水中,然后在培养基上培养,根据菌落数判断大麦表面的霉菌污染程度。
试剂和溶液
孟加拉红培养基(31.6g/L):称取31/6g孟加拉红培养基,加入1000ml水溶花,分装,于121℃ 20min高压灭菌备用。
仪器
- 摇床:转速180r/min~200r/min。
- 三角瓶:300ml。
- 培养皿:直径10cm。
移液管:0.2ml。
分析步骤
- A.1.4.1.称取麦粒试样10g(精确至0.02g)倒入盛有90ml无菌水的三角瓶中,塞紧棉塞,置于摇床上,在30℃,转速180r/min~200r/min下,振荡30min。
- 将孟加拉红培养基融化,在无菌条件下倒平皿,冷却为固体后备用。
- 在无菌条件下,用已灭菌的移液管吸取A.1.4.1液0.2ml涂于平皿上(每个试样平行做3个平皿),将平皿倒置,于25℃培养7天。
- 数平皿的菌落数。
大麦品种的鉴定
凝胶电泳法
原理
通过聚丙烯酰胺凝胶电泳(PAGE)鉴定大麦品种,用板式凝胶电泳分离大麦的醇溶蛋白部分。
试剂和溶液
- 萃取液:称取18g尿素和0.01g甲基绿,用水溶解,然后加入2-硫氢基乙醇1ml和2-氯乙醇20ml,再用水定容至100ml。
- 硫酸亚铁溶液(5g/L):按GBT 603-2002 化学试剂 试验方法中所用制剂及制品的制备配置。
- 凝胶贮备液:称取115.3g丙烯酰胺、4.6g亚甲叉双丙烯酰胺、69.2g尿素、1.2g甘氨酸、1.2g抗坏血酸,用水溶液,加入3ml硫酸亚铁溶液(新配置的)、23ml冰乙酸,混匀,并定容至1L。抽滤后装入棕色瓶中,与4℃下贮存,当月使用。
- 过氧化氢溶液:吸取30%过氧化氢2ml,用水定容至100ml。
- 电极缓冲溶液:称取2g甘氨酸,用水溶解,加入20ml冰乙酸,再加水至5L。
- 三氯乙酸溶液(10g/L):称取10g三氯乙酸,用水溶解,并定容至100ml。
- 考马斯亮蓝溶液(10g/L):称取1g考马斯亮蓝,用95%乙醇溶解,并定容至100ml。
- 染色溶液:吸取20ml三氯乙酸溶液,加入1ml考马斯蓝溶液,混合备用。
仪器
- 垂直板式凝胶电泳仪
- 分析天平:感量0.1mg
- 离心机:转速5000r/min,离心管φ9mm×35mm
分析步骤
- 样品数:取100粒大麦用于本测定。
- 萃取大麦醇溶蛋白:单独碾碎每粒大麦并放入离心管中,吸取0.4ml萃取液混合,浸泡最少16h,使用前将离心管置于离心机中,在转速5000r/min下,离心30min。
- 凝胶的形成:于100ml凝胶贮备液中加入0.15ml过氧化氢溶液,混匀。将已充分混匀的溶液灌入灌胶模具中(要保证凝胶有1.5mm厚度,10cm~15cm长度),在几分钟内聚合即会发生。用一把梳子在凝胶内开槽,以便放置样品(梳子一定要在刚刚灌胶时放入)。
- 凝胶展层:撤掉梳子,吸取适量的萃取液10μL~20μL加入凝胶顶部的槽内(若条带分离不清,则取量可减少),将每一槽装上样品,把凝胶玻板垂直地放入缓冲溶液中,使槽在板的上侧,让自来水循环流过电泳仪的冷却装置,使溶液冷却并保持在10℃~20℃。在200V下凝胶展层20min,然后在500V下继续展层,时间为色带(甲基绿)通过凝胶所需要时间的两倍。
- 凝胶展层后,将凝胶从玻璃板上取下,立即在染色液中染色,凝胶可持续染色一夜。
- 照相:凝胶染色后在蒸馏水中浸泡1h脱色,然后取出放在灯箱上照相,脚板与镜头约400mm。
- 结果的显示:根据与用纯品种所得结果进行比较后,可对大麦样品中的各种品种做定性的阐明,为定出各种品种的量,要用存存在于样品中的每一品种已确认的谷粒数除以谷粒的总数(100)。若做平行试验,则需要平均值表示(用百分数),并四舍五入至整数。
聚合酶链式反应法
原理
通过聚合酶链式反应(PCR)扩增技术,对大麦DNA进行体外酶促扩增。经聚丙烯酰胺凝胶电泳分离扩增产物后,与原大麦纯品种基因图谱进行对照鉴定待测大麦样品。
试剂和溶液
- A.2.2.2.1.Tris-盐酸溶液(1mol/L,pH=8.0):称取121.1g三羟甲基氨基甲烷(Tris),用800ml去离子水溶解,冷却至室温后用浓盐酸调节溶液的pH值至8.0(约需42ml浓盐酸),加水定容至1L,分装后高压灭菌。
- A.2.2.2.2.EDTA溶液(0.5mol/L,pH=8.0):称取186.1g乙二胺四乙酸二钠(EDTA,C10H14N2O8Na2·2H2O),加入800ml水中,在磁力搅拌器上搅拌,用氢氧化钠调节溶液的pH值至8.0(约需20gNaOH颗粒)然后定容至1L,分装后高压灭菌。
- A.2.2.2.3.DNA提取液:称取46.75g氯化钠和20g溴代十六烷基三甲铵(CTAB),加入800ml去离子水,摇动容器使溶质完全溶解。然后加入50ml Tris-盐酸溶液(A.2.2.2.1)和20ml EDTA溶液(A.2.2.2.2),用水定容至1L,分装后高压灭菌。
- A.2.2.2.4.三氯甲烷-异戊醇溶液(24+1):量取240ml三氯甲烷和10ml异戊醇混匀。
- 核糖核酸酶A(RNaseA,10mg/ml):生化试剂公司购买。
- PCR扩增试剂:生化试剂公司购买[PCR扩增试剂包括:Taq DNA聚合酶、dNTP、氯化镁(MgCl2)、PCR缓冲液(含MgCl2)、引物(Primer)]。
- A.2.2.2.7.电泳缓冲液I(10×TBE):称取108g Tris碱、55g硼酸和7.44gEDTA混合,用重蒸馏水溶解后,再定容至1L。
- 电泳缓冲液II(50×TAE):称取242g Tris碱和37.2g EDTA混合,加入57.1ml冰醋酸,用重蒸馏水溶解后,定容至1L。
- TE缓冲液:在800ml水中依次加入10ml Tris-盐酸溶液(A.2.2.2.1)、2ml EDTA溶液(A.2.2.2.2),加水定容至1L,分装后高压灭菌。
- 无菌水:取重蒸馏水100ml~200ml,在121℃灭菌20min。
- 变性上样缓冲液:称取10g蔗糖、20mg溴酚蓝、20mg二甲苯青,溶于90ml去离子甲酰胺中,用重蒸馏水定容至100ml。
- A.2.2.2.12.固定液(10%):量取100ml冰醋酸,加入900ml重蒸馏水,混匀。
- A.2.2.2.13.硫代硫酸钠溶液(10%):称取10g硫代硫酸钠,加入100ml重蒸馏水溶解。
- A.2.2.2.14.凝胶液(6%):称取60g丙烯酰胺、3.1g亚甲叉双丙烯酰胺、420g尿素和吸取50ml电泳缓冲液I(A.2.2.2.7)混合,用重蒸馏水溶解后,在定容至1L。
- A.2.2.2.15.凝胶染色液:称取1g硝酸银,加入1000ml重蒸馏水,再加入1.5ml甲醛,混匀。
- A.2.2.2.16.凝胶显影液:称取30g无水碳酸钠,加入1000ml重蒸馏水溶解后,再加入0.2ml硫代硫酸钠(A.2.2.2.13)和1.5ml甲醛,混匀。
- A.2.2.2.17.琼脂糖凝胶(0.8%):称取0.8g琼脂糖加入100ml 1×TAE电泳缓冲液II后,加热溶解。
- 乙醇(70%):吸取700ml无水乙醇,加水定容至1L。
仪器
- PCR仪:温度梯度变化反应灵敏准确。
- 恒压电泳仪:电压10V~3000V、电流2mA~200mA、功率5W~200W。
- 离心机:低温可达4℃以下、转速10000r/min。
- 恒温水浴:控温精度±0.1℃。
- 微量移液器:精确到0.1ml。
- 凝胶成像仪:可连接电脑拍照。
- 电泳槽:垂直电泳槽和水平电泳槽。
- 回旋水平脱色摇床:转速1000r/min~10000r/min。
- X光等。
- 玻璃板。
- 离心管:1ml~2ml。
- PCR薄壁管。
- 分析天平:感量0.1mg。
分析步骤
- DNA的提取(CTAB法)
- 取适量大麦新鲜叶片在研钵中放入液氮后研磨,使其呈细粉状。操作过程中小心冻伤。
- 取0.5g左右的大麦叶片组织放入一支2ml灭菌离心管中,加入800μL~900μL DNA提取液(A.2.2.2.3),轻轻颠倒混匀后,在65℃恒温水浴中保温40min~1h,中间每隔10min颠倒一次。
- 从水浴中取出在冰上放置5min,加入等体积的三氯甲烷-异戊醇溶液(A.2.2.2.4),颠倒混匀(先慢后快)10min,在低温(4℃)下,8000r/min~10000r/min离心10min。
- 取上清液移入另一只2ml灭菌离心管中,加入3μL RNaseA,置于37℃恒温水浴30min(取出DNA中的RNA)。
- 在37℃保温后加等体积的三氯甲烷-异戊醇溶液(A.2.2.2.4),颠倒混匀(先慢后快)10min,在低温(4℃)下,8000r/min~10000r/min离心10min。
- 取上清液移入另一只2ml离心管中,加入2倍体积的无水乙醇(置于-20℃冷冻),颠倒混匀,室温下静止约3min。
- 用灭菌枪头挑出DNA,并用70%乙醇漂洗2~3次,室温下放置干燥,乙醇挥发后加入100μL 1×TE或者无菌水溶解。
- 用琼脂糖凝胶(A.2.2.2.17)检测(约需2μL~3μL),电泳后放凝胶于凝胶成像仪拍照。样品于-20℃保存备用。
- PCR扩增
- 在PCR薄壁管中用微量移液器依次加入12.8μL无菌水、2μL PCR缓冲液、2μL 200μmol/L dNTP、2μL 500 μmol/L引物、0.2μL 1 U/μL Taq DNA聚合酶,最后加入1μL大麦DNA(浓度30ng/μL~50ng/μL)始终体积达20μL,加5μL矿物油离心10s,混匀放入PCR仪扩增。
- 大麦模板先在94℃预变性5min后,按下列条件进行扩增循环35个轮次:
- 94℃变性30s;
- 55℃退火40s;
- 72℃延伸40s。
- 最后在72℃下保温10min结束扩增程序,取出扩增产物放置于4℃冰箱备用。
- 聚丙烯酰胺凝胶版的制作
- 首先用自来水将玻璃平板和耳朵板冲洗干净。
- 区分好凉快玻璃板正反面后用乙醇分别擦拭一遍。
- 待乙醇挥发后在平板一面用亲和硅烷均匀涂抹两次,耳朵板用剥离硅烷均匀涂抹两次(此操作在通风橱下操作,小心被腐蚀)。
- 上述步骤完成后,将两片压条分别放于平板(涂亲和硅烷一面)两侧,并将耳朵板(涂剥离硅烷一面)盖于平板上面,用夹子夹紧。
- 将凝胶贮存液(A.2.2.2.14)沿两板之间的缝隙(耳朵板一侧)缓慢灌入,灌胶过程中勿使气泡产生,避免对实验产生影响(60ml凝胶贮存液+200μL 10%过硫酸铵+100μL TEMED)。
- 胶灌好以后,将梳子(不带齿子一端)插入胶面,插入深度要适宜。
- 室温放置1h~2h静止凝胶(依据温度确定凝胶时间)。
- 预电泳
- 凝胶固定好以后将梳子拔出,平板一面向外,耳朵板一面向内放于垂直电泳槽内,两端用铁夹子夹紧。
- 将电泳缓冲液I(A.2.2.2.7)稀释为0.5×TBE,灌于垂直电泳槽上下槽内,吹净胶板上样端的碎胶。
- 将电泳槽的电源线连接电泳仪后,通电。70W恒功率电泳30min。
- 上样跑电泳
- 30min预电泳后断电,将梳子(有齿一端)插入胶板内,适宜深度。
- 将PCR扩增产物加入变性上样缓冲液后,在PCR仪内94℃变性5min,并迅速转移至冰水内冷却。
- 取3μL~5μL变性扩增产物梳子孔加入,启动电源,70W恒功率电泳45min。
- 银染显影
- 电泳后将玻璃板分开,把平板(粘有凝胶的玻璃板)放入装有固定液(A.2.2.2.12)的洗脱盒内,在回旋水平摇床上振荡20min~30min,固定脱色。
- 脱色后用重蒸馏水水洗2次~3次,3min/次~5min/次。
- 用凝胶染色液(A.2.2.2.15)染色20min~30min。
- 迅速用正中流水水洗8s~10s。
- 用凝胶显影液(A.2.2.2.16)显影,直到可见清晰带为止。
- 用10%冰醋酸固定3min~5min。
- 用重蒸馏水水洗3min~5min,室温下风干。
- 结果的显示
- 将风干后的玻璃板放在X光灯箱上,与已知大麦品种的原纯品种基因图谱进行观测比较,详细记录。
水敏感性测定
原理
取两组试样,分别加入4ml和8ml水,保温发芽,两组发芽麦粒的百分数之差,即为水敏感性。
仪器
- 培养皿:直径10cm
- 刻度吸管:分度值0.1ml
分析步骤
取两组培养皿,分别将两张9cm的滤纸放入培养皿底部,再分别加入4.0ml和8.0ml水均匀润湿滤纸。各取100粒大麦试样放在滤纸上,使每一麦粒的腹部很好地与滤纸接触,盖上皿盖。将培养皿放入塑料袋密闭,以防止水蒸发。在温度18℃~20℃,于暗处培养。在浸渍开始后24h、48h和72h各拣除一次发芽的麦粒。
结果计算
精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的3%。